Aída Martínez-López
Diana Gendron
Gerardo Verdugo-Díaz
Instituto Politécnico Nacional, Centro Interdisciplinario de Ciencias Marinas, Av. Instituto Politécnico Nacional, Col. Playa Palo de Santa Rita 23096, La Paz, B.C.S. México.
Introducción
El océano nos ofrece múltiples oportunidades de entender cómo funciona a través de las respuestas de diferentes integrantes de la comunidad marina. Un caso extremo lo representan las algas microscópicas y las ballenas, las cuales se encuentran en los límites del espectro de tamaños en el ambiente marino; un alga microscópica mide una millonésima parte de un metro ó micrómetros (entre 0.2 y hasta ~2000 μm) mientras que la ballena más grande puede alcanzar los 30 m.
La influencia de las variables ambientales en las algas microscópicas marinas y por ende en la productividad primaria de los ecosistemas marinos provoca una variación en la producción regional de hasta 10 veces entre zonas eutróficas y subtropicales oligotróficas. Sin embargo, un caso particular lo constituye el Golfo de California y sus sistemas costeros, qué aunque están ubicados en latitudes subtropicales áridas, son de los más productivos del mundo. Los procesos hidrodinámicos en estas áreas ocurren rápidamente y sus propiedades físico-químicas, geoquímicas y biológicas determinan la estacionalidad en los niveles de productividad primaria. Este patrón estacional de la productividad primaria es inestable a largo plazo, ya que puede verse alterado por los cambios regionales que ocurren en las condiciones atmosféricas y la circulación oceánica vinculados a la variabilidad climática.
El Golfo de California localizado en la región árida-semiárida del Noroeste Mexicano, nos ofrece la oportunidad de entender los efectos de la variabilidad del clima en los ecosistemas marinos y en la respuesta de los productores primarios (algas microscópicas). Particularmente en el lado peninsular del golfo, donde debido a la ausencia de ríos, los vientos intensos del noroeste aportan a los sistemas costeros una importante cantidad de polvo continental, que contiene elementos mayores de origen terrígeno (aluminio y titanio) y micronutrientes tales como el hierro, lo que contribuye sustancialmente a incrementar la producción de las algas microscópicas.
Este aporte eólico de nutrientes se complementa con otras fuentes adicionales de nutrientes, entre ellas la que proviene de las heces de ballena azul, que visitan anualmente la región costera entre las ciudades de Loreto y La Paz, la cual es única en el mundo por ser una zona de nacimiento, crianza y alimentación [1], [2]. En el proceso de alimentación, las ballenas engullen una enorme cantidad de agua equivalente a su propia masa, que para una ballena de ~27 metros de largo se traduce en más de cien toneladas de agua [3], que necesita ser filtrada instantáneamente a través de las barbas sujetadas en la mandíbula superior (Fig. 1). Este enorme volumen de agua contiene todas las partículas suspendidas incluidas las de polvo, además de grandes cantidades de presas, las cuales en el Golfo de California son principalmente krill y peces linternas (estos últimos detectados mediante el análisis del material genético o ADN en las heces) [4], [5]. De esta forma, las heces representan una fuente importante de información ecológica, biogeoquímica y climática.
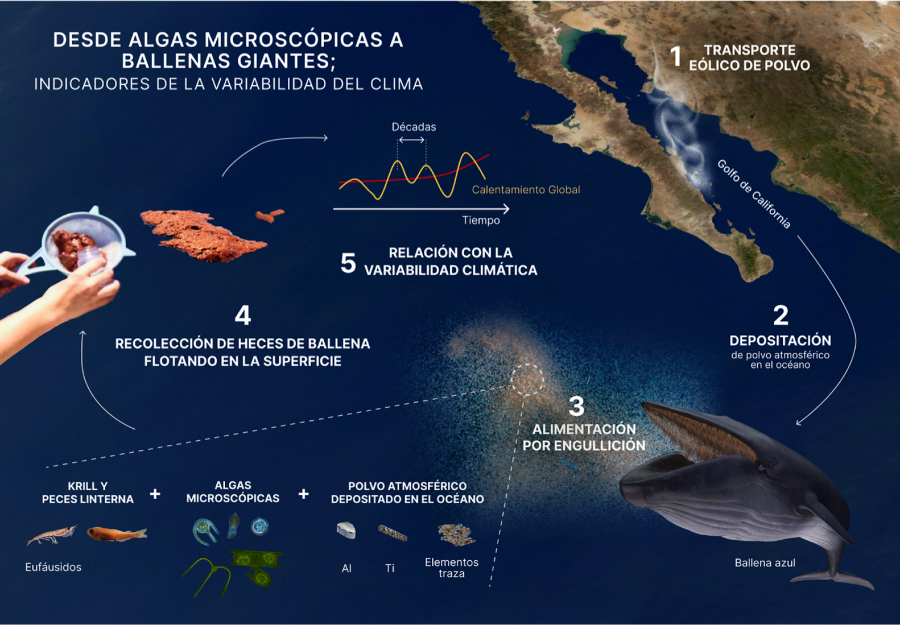
Las heces son fáciles de recolectar ya que flotan en la superficie del mar [2], por lo que su recolección con fines de investigación, se ha realizado desde hace más de 2 décadas. Así, usando submuestras de estas heces, se realizaron dos investigaciones paralelas. En la primera, se realizó un experimento en el mar que mostró que las heces aportan nutrientes esenciales para la base de la trama trófica donde las algas microscópicas son participantes esenciales, ya que realizan la transformación de compuestos inorgánicos a orgánicos a través de la fotosíntesis. En este experimento se demostró que las heces propician un incremento en la abundancia de algas microscópicas nativas (fitoplancton) y en los niveles de productividad primaria del Parque Nacional Bahía de Loreto [6]. Lo anterior se observó también al fertilizar (en laboratorio) con estas mismas heces muestras de agua conteniendo algas microscópicas de la Bahía de La Paz, en donde se documentó que los valores de productividad primaria y abundancia de las algas microscópicas mostraron diferencias significativas con las muestras sin adición de heces de ballena azul (Verdugo-Díaz et al., en preparación). En la segunda investigación, se determinó que además de las presas, el agua de mar contiene partículas minerales (polvo) que se depositan en el océano, que de esta forma pasan al tracto digestivo de las ballenas y finalmente a las excretas. La concentración de los elementos traza y de los elementos mayores como el aluminio y el titanio (que no son utilizados metabólicamente), en las heces de las ballenas azules, revela información valiosa respecto del clima, por ejemplo, sobre la variabilidad del viento [7].
En el mismo orden de ideas, las algas microscópicas, por sí mismas, debido a que tienen ciclos de vida muy cortos (días) son altamente sensibles a cambios en el océano, incluyendo aquellos provocados por la variabilidad del clima. Así de manera directa o indirecta los cambios en la abundancia o en las especies también pueden ser utilizados como indicadores de la variabilidad del clima [8] (Fig. 2), lo que complementa la información obtenida a partir del análisis químico de las heces de ballena azul.

Referencias
[1] Gendron D. 2002. Ecología poblacional de la ballena azul, Balaenoptera musculus, de la Península de Baja California. Centro de Investigación Científica y de Educación Superior de Ensenada. 105 pp.
[2] Flores-Cascante L, Gendron D. 2012. Application of McMaster’s technique in live blue whales. Veterinary Record, 171:220, Doi: 10.1136/vr.100749.
[3] Potvin J, Werth AJ. 2017. Oral cavity hydrodynamics and drag production in balaenid whale suspension feeding. PLoS One 12: 5220.
[4] Jiménez-Pinedo C. 2010. Hábitos alimentarios y relación interespecífica de la ballena azul (Balaenoptera musculus) y de aleta (Balaenoptera physalus) en el suroeste del Golfo de California. Tesis de Maestría CICIMAR-IPN.
[5] Delgado-Rodríguez JV. 2022. Composición en la dieta de la ballena azul del Golfo de California mediante la escatología molecular. Tesis de maestría CICIMAR-IPN.
[6] Casillas-López C, Gendron-Laniel D, Martínez-López A. 2018. Recicladores gigantes: El rol bioquímico de la ballena azul en su hábitat. XXXVI Reunión Internacional para el Estudio de los Mamíferos Marinos. Villahermosa, Tabasco, México, 27 – 31 de mayo, 2018. pp. 61.
[7] Corona-Meléndez CA, Gendron-Laniel D, Martínez-López A. 2021. Contenido de elementos mayores en heces de rorcuales y su potencial como indicadores indirectos de la variabilidad climática. XXXVII Reunión Internacional para el Estudio de los Mamíferos Marinos “Investigación, Fundamento de la Conservación”. BCS, México, 2 – 6 de mayo, 2021.
[8] Martínez-López, A, Álvarez-Gómez IG, Pérez Cruz L, Verdugo-Díaz G, Villegas Aguilera MM. 2016. Production, exportation and preservation of silicoflagellates in Alfonso Basin, Gulf of California. Journal of Sea Research, 109: 52 – 62. DOI:10.1016/j.seares.2016.01.005.
