Sergio Flores-Ramírez1*, Jorge Antonio Guzmán – Segura1, Roberto Carmona-Piña2, José Loya – Ramírez3
1 Laboratorio de ecología molecular y genética aplicada a conservación. Universidad Autónoma de Baja California Sur. Km. 4.5. carretera al sur S/N, La Paz, BCS, 23080, México.
2 Departamento Académico de Ciencias Marinas y Costeras. Universidad Autónoma de Baja California Sur. Km. 4.5. carretera al sur S/N, La Paz, BCS, 23080, México.
3 Maestría en Ciencias de Innovación en Producción Orgánica en Ambientes Áridos y Costeros. Universidad Autónoma de Baja California Sur. Km. 4.5. carretera al sur S/N, La Paz, BCS, 23080, México.
Introducción.

A nivel global, los mosquitos amenazan seriamente la salud de personas y animales. Estos pueden transmitirnos virus y otros microbios peligrosos, cuando, para alimentarse de nuestra sangre nos pican (Socha et al., 2022, Fig. 1).
En México, varias especies de mosquitos transmiten enfermedades graves causadas por virus (p. ej., Dengue, Zika y Chikungunya). Estas afectan particularmente a niños y ancianos, a quienes pueden causar daños permanentes, o la muerte (Foster & Walker, 2019). En Baja California Sur (BCS), donde se han reportado casos de Dengue y Zika (Serrano-Pinto & Moreno-Legorreta, 2017, Secretaria de Salud- México, 2024), conocer mejor las especies de los mosquitos y su vida, nos facilitará combatirlos, y evitar transmitan enfermedades.
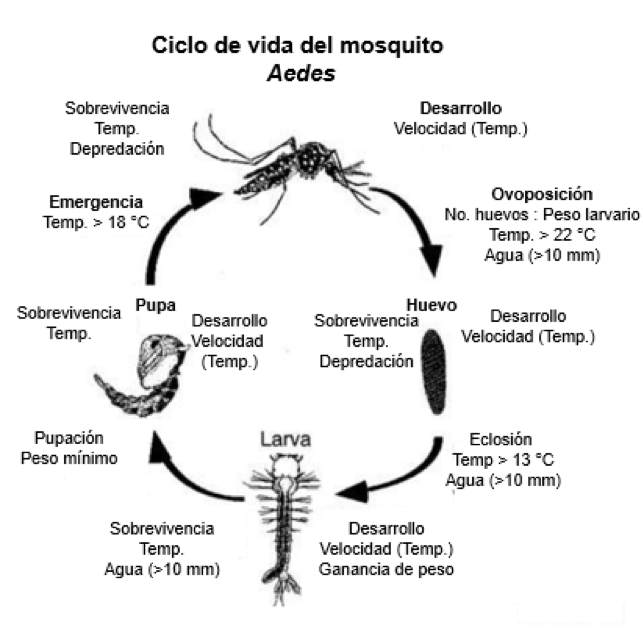
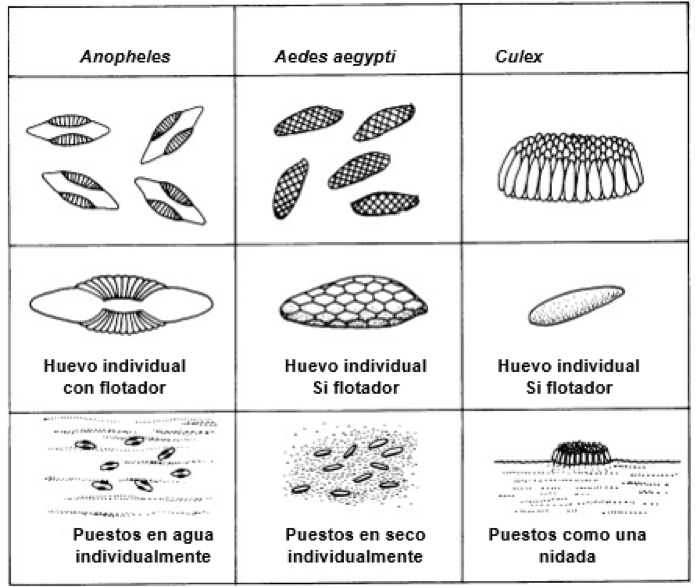
El ciclo de vida de los mosquitos comprende cuatro etapas (Fig. 2): huevo, larva, pupa y adulto (Crans, 2004). Este inicia cuando, después de aparearse y alimentarse de sangre, las hembras grávidas localizan aguas estancadas ricas en nutrientes, donde ponen sus huevos, acorde a la ecología de cada especie (Fig. 3).


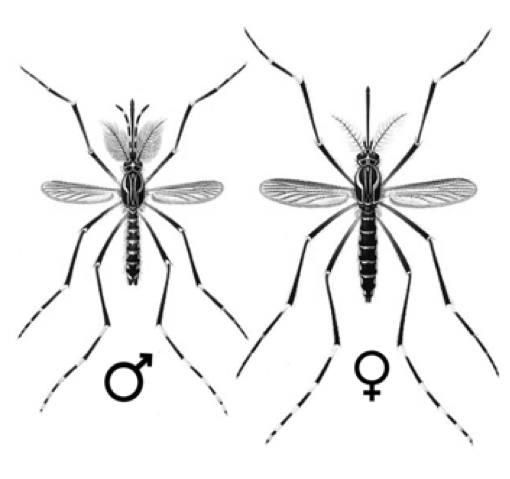
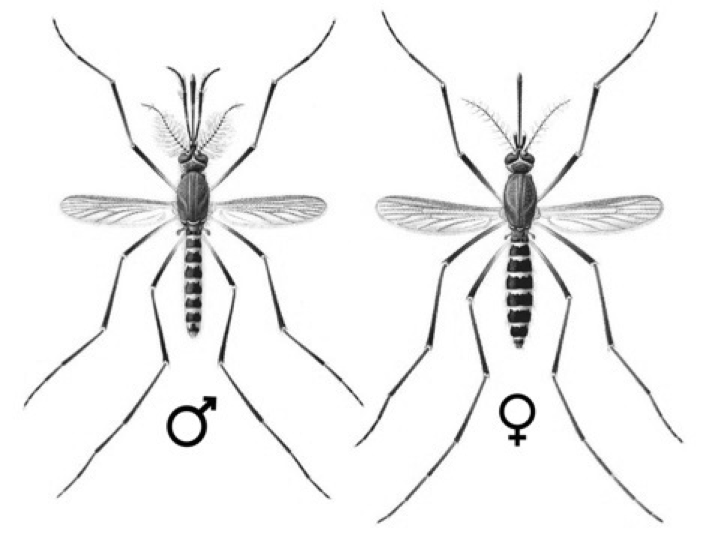
De los huevos nacen larvas que se alimentan de microorganismos o materia orgánica particulada (Crans, 2004). Estas, tienen un tubo en su cola que sobresale del agua, con el que respiran (Fig. 4) (pocas especies de mosquitos tienen larvas que respiran bajo el agua). Después de 2 a 5 días, las larvas se transforman en pupas (distinguibles por sus “trompetas” respiratorias, Fig. 5), las que después de unas 36 horas, se transforman en mosquitos adultos, dependiendo de la temperatura (Ciota et al., 2014; Rossi et al., 2014). Los mosquitos macho se distinguen por sus antenas plumosas (Gibson & Russell, 2006, Fig. 6), con las que localizan hembras. Ambos sexos pueden alimentarse del néctar, pero después de aparearse, las hembras, según su especie, se alimentarán de sangre de una o varias especies de mamíferos y/o aves, para promover la maduración de sus huevos y buscarán agua estancada para ponerlos. Así, el ciclo comienza de nuevo.
Mosquitos que amenazan tu salud.
Aedes aegypti (Fig. 7a) y Aedes albopictus (Fig. 7b), son los principales transmisores de Dengue en BCS y una seria amenaza para la salud humana y animal (Rey & Lounibos, 2015): Ambas especies, se distinguen por las bandas blancas de sus patas traseras y las marcas blancas en forma de lira de su cuerpo (Soares ET AL., 2022). Son de origen tropical, y aunque su capacidad de dispersión es poca, su estrecha convivencia con nosotros ha favorecido su gran expansión en el Continente Americano (Rey & Lounibos, 2015).

Las hembras ponen huevos, justo por encima del nivel del agua estancada (en neumáticos viejos, macetas, latas, estanques, etc.). Estos, pueden soportar fuera del agua, hasta un año, y reanudan su desarrollo cuando el nivel del agua sube (p. ej. con la lluvia) y los alcanza (Crans, 2004). Después de nacer, la velocidad de desarrollo de larva a adulto dependerá de la temperatura (Crans, 2004; Ciota et al., 2014; Rossi et al., 2014, Rey & Lounibos, 2015). Las hembras adultas suelen picar los tobillos, especialmente al anochecer. Ambas especies transmiten los virus del Zika, Chikungunya, Nilo Occidental (E.G., Chouin-Carneiro, & dos Santos, 2017), y el de la Fiebre Amarilla (Kamgang, et al., 2019), una gran amenaza; pues, aunque en México esta se declaró erradicada en 1963 (Soper, 1967, Cueto, 2005), tras eliminar a su vector Aedes aegypti, la abundancia de este está aumentando.

Aedes vexans el mosquito de las inundaciones (Fig. 8). Transmite los virus de la encefalitis japonesa, Tahyna, Nilo Occidental, encefalitis equina occidental, y encefalitis de San Luis (Jones et al., 2020; Gendernalik et al., 2017). Además de los parásitos causantes de dirofilariosis canina. Los adultos son color marrón con marcas pálidas abdominales en forma de V. En hábitats inundados (e.g., patios, pastizales, estanques de aguas residuales, artesas, y áreas de drenaje de inundaciones), este mosquito es una plaga, dada su ferocidad, abundancia, amplia distribución y reproducción. Las hembras, depositan sus huevos en el suelo. Estos se activan y eclosionan al alcanzarles el agua de inundación, para originar una sola generación de larvas (Crans et al., 2004). Dependiendo de la temperatura, en aproximadamente una semana, las larvas se transformarán en pupas, y a su vez estas en mosquitos adultos en 2 a 5 días (Crans et al., 2004). Este mosquito puede dispersarse >18 km desde su punto de origen, lo que lo hace un vector peligroso (O’Donnell, 2017).
Culex quinquefasciatus, el mosquito casero (Fig. 9), se alimenta de sangre de diversos mamíferos y aves (Janssen, et al., 2015; McMillan et al., 2019). Transmite los virus del Nilo Occidental, Usutu, y encefalitis de San Luis, además de los parásitos causantes de malaria aviar y filariasis linfática (Kent et al., 2010; Huang et al., 2015; Samy et al., 2016; Cook et al., 2018). Su identificación es complicada (basada en la forma de los genitales de los machos). Las hembras grávidas ponen una nidada (grupo compacto de aprox. 300 huevos) (Fig. 3) en aguas estancadas -aguas residuales, fuentes para pájaros, neumáticos viejos o cualquier recipiente- (Schelble, 2014). Al nacer, las larvas se alimentan de microorganismos y materia orgánica particulada, y después de 2 a 5 días se transformarse en pupas, las que a su vez y dependiendo de la temperatura, se transformarán en mosquitos adultos en 2 a 5 días (Crans et al., 2004; Schelble, 2014).
Anopheles freeborni, el mosquito de la malaria (Fig. 10), se alimenta de sangre de diversos mamíferos y aves (Collins et al., 1997; Wekesa et al., 1997). Transmite el virus del Nilo Occidental a los humanos, y el de la mixomatosis a los conejos. Además, transmite parásitos causantes de malaria a humanos y aves (e.g., Dodson et al., 2018; Foster & Walker, 2019). Su identificación es complicada -basada en información genética. Cada etapa de su ciclo de vida es influenciada por distintos factores, como la temperatura y densidad poblacional, que determinan su capacidad como vector (Gubler et al., 2001, Eldridge, 2008). Sus larvas prefieren el agua clara y fresca de charcas iluminadas por el sol, o parcialmente sombreadas. Los adultos hibernan en las zanjas y campos de hierba (Eldridge, 2008)

Psorophora columbiae, el mosquito de los arrozales (Fig. 11), es grande y oscuro, con marcas blancas o amarillentas en el abdomen. Las patas son color marrón oscuro y están rayadas con escamas blancas. Las alas presentan motas marrón oscuro y blanco. Se alimenta de diversos animales de sangre caliente, llegando a afectar gravemente la productividad del ganado (Li et al., 2013; Pagès & Cohnstaedt, 2018). Transmite los virus del Nilo Occidental, y de la encefalitis equina venezolana; además de parásitos causantes de anaplasmosis vacuna (Bibbs et al., 2020). Las hembras ponen sus huevos en suelos húmedos sujetos a inundaciones recurrentes por lluvia o riego. Su incubación tarda de 3 a 5 días, y una vez que nacen, las larvas maduran rápidamente en climas calurosos, pudiendo transformarse en adultos en 3.5 días (Lee, 1989).
Bibliografía
Bibbs, C. S., Mathias, D., & Burkett-Cadena, N. D. (2020). Psorophora columbiae (Dyar & Knab), Dark rice field mosquito: EENY-735/IN1265, 8/2019. EDIS, 2020(2).
Ciota, A. T., Matacchiero, A. C., Kilpatrick, A. M., & Kramer, L. D. (2014). The effect of temperature on life history traits of Culex mosquitoes. Journal of medical entomology, 51(1), 55-62.
Chouin-Carneiro, T., & dos Santos, F. B. (2017). Transmission of major arboviruses in Brazil: the role of Aedes aegypti and Aedes albopictus vectors. Biological Control of Pest and Vector Insects, 2.
Collins, W. E., Richardson, B. B., Sullivan, J. S., Morris, C. L., & Galland, G. G. (1997). Infection of Anopheles freeborni mosquitoes on New World monkeys infected with the Uganda I/CDC strain of Plasmodium malariae. The Journal of parasitology, 1099-1103.
Crans, W. J. (2004). A classification system for mosquito life cycles: life cycle types for mosquitoes of the northeastern United States. Journal of Vector Ecology, 29, 1-10.
Cueto, M. (2005). Appropriation and resistance: Local responses to malaria eradication in Mexico, 1955–1970. Journal of Latin American Studies, 37(3), 533-559.
Cook, C. L., Huang, Y. J. S., Lyons, A. C., Alto, B. W., Unlu, I., Higgs, S., & Vanlandingham, D. L. (2018). North American Culex pipiens and Culex quinquefasciatus are competent vectors for Usutu virus. PLoS neglected tropical diseases, 12(8), e0006732.
Eldridge, B. F. (2008). Biology and control of mosquitoes. Vector-Borne Disease Section Center for Infectious Diseases. Sacramento: California Department of Public Health, 120.
Foster, W. A., & Walker, E. D. (2019). mosquitoes (Culicidae). In Medical and veterinary entomology (pp. 261-325). Academic press.
Gendernalik, A., Weger-Lucarelli, J., Luna, S. M. G., Fauver, J. R., Rückert, C., Murrieta, R. A., … & Ebel, G. D. (2017). American Aedes vexans mosquitoes are competent vectors of Zika virus. The American journal of tropical medicine and hygiene, 96(6), 1338.
Gibson, G., & Russell, I. (2006). Flying in tune: sexual recognition in mosquitoes. Current Biology, 16(13), 1311-1316.
Gubler, D. J., Reiter, P., Ebi, K. L., Yap, W., Nasci, R., & Patz, J. A. (2001). Climate variability and change in the United States: potential impacts on vector-and rodent-borne diseases. Environmental health perspectives, 109(suppl 2), 223-233.
Huang, Y. J. S., Harbin, J. N., Hettenbach, S. M., Maki, E., Cohnstaedt, L. W., Barrett, A. D., … & Vanlandingham, D. L. (2015). Susceptibility of a North American Culex quinquefasciatus to Japanese encephalitis virus. Vector-Borne and Zoonotic Diseases, 15(11), 709-711.
Janssen, N., Fernandez‐Salas, I., Díaz González, E. E., Gaytan‐Burns, A., Medina‐de la Garza, C. E., Sanchez‐Casas, R. M., … & Jöst, H. (2015). Mammalophilic feeding behaviour of Culex quinquefasciatus mosquitoes collected in the cities of Chetumal and Cancun, Yucatán Peninsula, Mexico. Tropical Medicine & International Health, 20(11), 1488-1491.
Jones, R., Kulkarni, M. A., Davidson, T. M., Radam-Lac Research Team, & Talbot, B. (2020). Arbovirus vectors of epidemiological concern in the Americas: a scoping review of entomological studies on Zika, dengue and chikungunya virus vectors. PloS one, 15(2), e0220753.
Kamgang, B., Vazeille, M., Yougang, A. P., Tedjou, A. N., Wilson-Bahun, T. A., Mousson, L., … & Failloux, A. B. (2019). Potential of Aedes albopictus and Aedes aegypti (Diptera: Culicidae) to transmit yellow fever virus in urban areas in Central Africa. Emerging microbes & infections, 8(1), 1636-1641.
Kent, R. J., Crabtree, M. B., & Miller, B. R. (2010). Transmission of West Nile virus by Culex quinquefasciatus say infected with Culex Flavivirus Izabal. PLoS neglected tropical diseases, 4(5), e671.
Lee, D. K. (1989). The effects of certain physical and biological factors on the survival and the hatching rates of Psorophora columbiae (Dyar and Knab)(Diptera: Culicidae) eggs. Texas A&M University.
Li, S., Gouge, D., Fournier, A., Nair, S., Baker, P., & Olson, C. (2013). Mosquitoes.
McMillan, J. R., Marcet, P. L., Hoover, C. M., Mead, D., Kitron, U., & Vazquez-Prokopec, G. M. (2019). Feeding success and host selection by Culex quinquefasciatus Say mosquitoes in experimental trials. Vector-Borne and Zoonotic Diseases, 19(7), 540-548.
O’Donnell, K. L., Bixby, M. A., Morin, K. J., Bradley, D. S., & Vaughan, J. A. (2017). Potential of a northern population of Aedes vexans (Diptera: Culicidae) to transmit Zika virus. Journal of medical entomology, 54(5), 1354-1359.
Pagès, N., & Cohnstaedt, L. W. (2018). Mosquito-borne diseases in the livestock industry. In Pests and vector-borne diseases in the livestock industry (pp. 129-144). Wageningen Academic Publishers.
Rey, J. R., & Lounibos, P. (2015). Ecology of Aedes aegypti and Aedes albopictus in the Americas and disease transmission. Biomédica, 35(2), 177-185.
Rossi, M. M., Ólivêr, L., & Massad, E. (2014). Modelling the implications of temperature on the life cycle of Aedes aegypti mosquitoes. Ecological Modelling Applied to Entomology, 81-107.
Samy, A. M., Elaagip, A. H., Kenawy, M. A., Ayres, C. F., Peterson, A. T., & Soliman, D. E. (2016). Climate change influences on the global potential distribution of the mosquito Culex quinquefasciatus, vector of West Nile virus and lymphatic filariasis. PloS one, 11(10), e0163863.
Socha, W., Kwasnik, M., Larska, M., Rola, J., & Rozek, W. (2022). Vector-borne viral diseases as a current threat for human and animal health—One Health perspective. Journal of Clinical Medicine, 11(11), 3026.
Secretaria de Salud – México (2024). Casos Confirmados Autóctonos de Enfermedad por Virus del Zika por Entidad Federativa SEMANA EPIDEMIOLÓGICA 39, 2024. https://www.gob.mx/cms/uploads/attachment/file/948032/CuadroCasosZikayEmbsem39_2024.pdf
Serrano-Pinto, V., & Moreno-Legorreta, M. (2017). Dengue hemorrhagic fever in the northwest of Mexico: a two-decade analysis. Revista de investigación clínica, 69(3), 152-158.
Schelble, S. S. (2014). Effects of Water Parameters on Container Mosquito (Diptera: Culicidae) Oviposition and Performance.
Soares, I. M. N., Polonio, J. C., Zequi, J. A. C., & Golias, H. C. (2022). Molecular techniques for the taxonomy of Aedes Meigen, 1818 (Culicidae: Aedini): A review of studies from 2010 to 2021. Acta Tropica, 236, 106694.
Soper, F. L. (1967). Aedes aegypti and yellow fever. Bulletin of the World Health Organization, 36(4), 521.
Wekesa, J. W., Yuval, B., Washino, R. K., & De Vasquez, A. M. (1997). Blood feeding patterns of Anopheles freeborni and Culex tarsalis (Diptera: Culicidae): effects of habitat and host abundance. Bulletin of Entomological Research, 87(6), 633-641.
