Autores: Gárate-Lizárraga, Ismael, Verdugo-Díaz, Gerardo
Instituto Politécnico Nacional, Centro Interdisciplinario de Ciencias Marinas (CICIMAR), Av. Instituto Politécnico Nacional s/n, Col. Playa Palo de Santa Rita, La Paz, Baja California Sur, 23096, México
Dentro de la ecología marina, uno de los fenómenos más interesantes y estudiados, sobre todo en las últimas décadas, son las mareas rojas o proliferaciones algales. El término marea roja fue uno de los primeros que se utilizaron, haciendo referencia al color rojizo que se presentaba durante el incremento exponencial de microalgas (Blake et al., 2022), sin embargo, al paso del tiempo ha ido cayendo en desuso dado que se ha observado que una proliferación de microalgas puede ocasionar un cambio de color, el cual puede ir desde un verde oliva, café, dorado o naranja, según los pigmentos dominantes de las microalgas formadoras del evento (Fig. 1). Es importante señalar que estos fenómenos han recibido diversos nombres según la zona o del país en el que se registran. De manera genérica se les llama marea roja o proliferación fitoplanctónica, no obstante, también son referidos como “Afloramientos”, “Floraciones”, o “Florecimientos”, y blooms (tomado de la lengua inglesa). De acuerdo con Suarez-Isla (1992) y Ochoa et al. (2005) estos eventos reciben otros nombres como: “aguaje” (Perú), “purga do mar” (Galicia, España), “eau rouges” (Francia), “l’acqua rossa” (Italia), “akashiwo” (Japón), “red tides” o “red waters” (países angloparlantes), “tingui” o “aguji” (Cuba) “turbio” (Venezuela), “huirihue” o “virigue” (norte de Chile).

En un principio, estos eventos fueron relacionados principalmente con especies de dinoflagelados, sin embargo, estudios más recientes han evidenciado que igualmente son importantes las proliferaciones de especies de diversos grupos fitoplanctónicos (Fig. 2) como diatomeas, silicoflagelados, rafidofitas, cianobacterias planctónicas e incluso ciliados como Myrionecta rubra (Cortés-Altamirano, 1984; Gárate-Lizárraga et al., 2001; 2006; Band-Schmidt et al., 2005; López-Cortés et al., 2008; Gárate-Lizárraga y Muciño-Márquez, 2012).

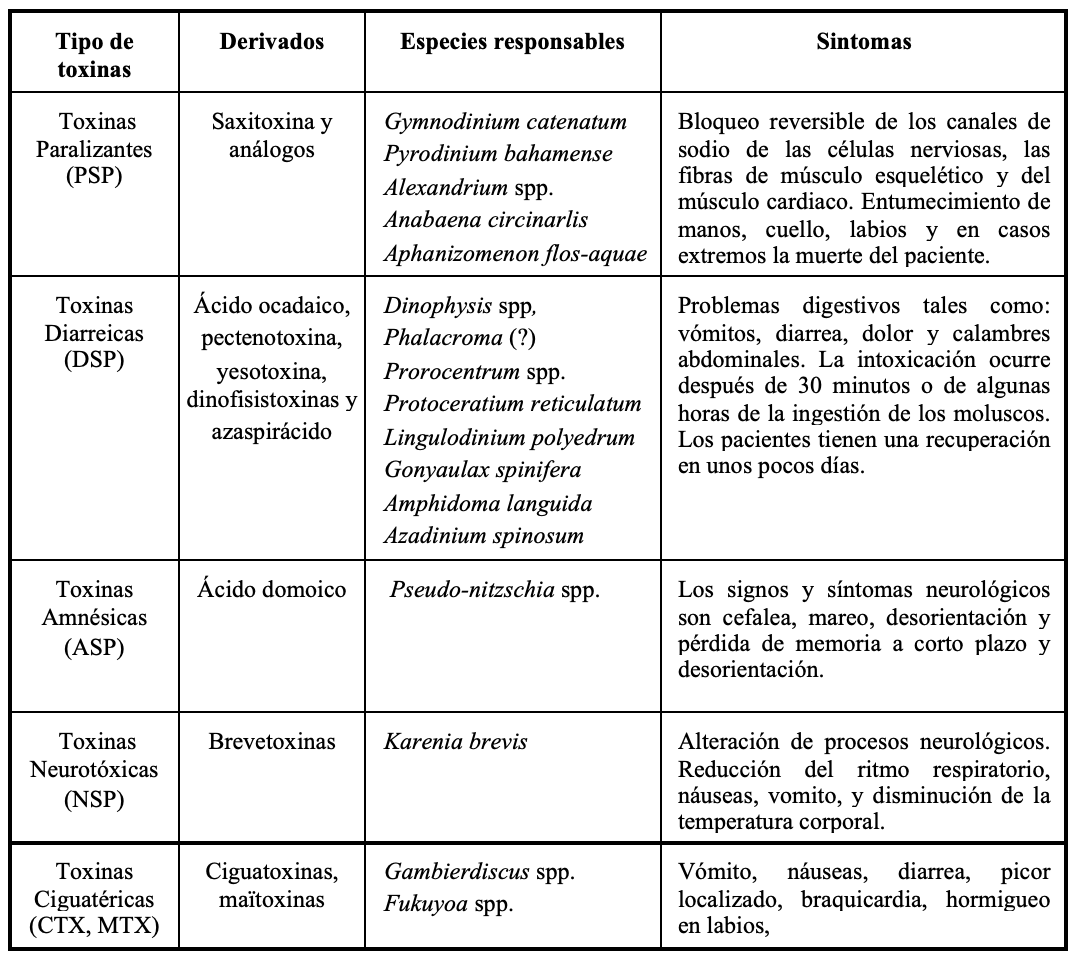
Es importante mencionar que las microalgas en general juegan un importante papel en el ecosistema marino ya que forman parte del primer eslabón de la trama alimenticia, aportando carbono orgánico para niveles tróficos superiores, sin embargo, es de considerar que bajo ciertas condiciones la proliferación de microalgas puede ser un factor negativo para la salud del ecosistema y sus recursos bióticos, afectando también las actividades turísticas y recreativas. En este sentido han sido catalogadas como de carácter tóxico, nocivas o incluso inocuas y benéficas. Estos eventos pueden ser de origen natural o antropogénico. por lo cual su formación y persistencia son el producto de la combinación de múltiples factores, lo cual los hace difícilmente predecibles. Sus efectos, sin importar su origen son diversos, pudiendo ocasionar daños al ecosistema marino o incluso a la salud humana cuando se consumen productos contaminados por su exposición a las toxinas derivadas de estas proliferaciones microalgales (Tabla I: Hernández-Orozco y Gárate-Lizárraga, 2006; Visciano et al., 2016; Montoya et al., 2020).
A nivel global su aparición ha sido reportada en todas latitudes, por lo cual nuestro país no ha sido ajeno a estos eventos y su presencia ha sido registrada tanto en las costas de océano Atlántico como del Pacífico. Con relación a nuestro estado, es importante mencionar que Baja California Sur tiene un área aproximada de 73,677 km2, la cual representa tan solo el 3.8 % de la superficie total de México, siendo el noveno lugar en extensión territorial, sin embargo, es el estado que cuenta con mayor línea de costa representada por 2,220 km (1,400 km correspondientes al Pacifico y 820 km dentro del Golfo de California). Su gran extensión costera permite que se encuentren diferentes ecosistemas marinos, asociados con una alta biodiversidad con especies tanto de afinidad tropical y templada (Cortes-Ortiz et al., 2006).
Las costas de nuestro estado han sido testigo de proliferaciones algales tanto tóxicas como nocivas e inocuas, particularmente el Golfo de California, el cual es una zona en donde las mareas rojas han sido recurrentes (Gárate-Lizárraga et al., 2016a) desde que se tiene memoria, en este mismo sentido, algunos autores han solido llamar al Golfo de California como “Mar Bermejo” en alusión directa a las tonalidades rojizas que puede tomar al presentarse proliferaciones exponenciales de microalgas (Cortés-Altamirano y Licea-Durán, 1999).
En el CICIMAR se cuenta con un equipo integrado por personal altamente especializado en el monitoreo y análisis de estos fenómenos por lo cual, su estudio se ha llevado a cabo desde diversas disciplinas científicas como la ecología, fisiología, toxicología y taxonomía. Gárate-Lizárraga et al. (2001) reportaron 30 eventos de mareas rojas observadas tanto en ecosistemas de la costa occidental de BCS como en el Golfo de California en el periodo comprendido entre 1984 y 2001. Una revisión reciente realizada por Gárate-Lizárraga et al. (2016a, 2016b) mostró un incremento importante de mareas rojas en las últimas tres décadas. Cabe señalar que dentro de estos eventos se registraron tanto de carácter nocivo como tóxico, cobrando importancia por su toxicidad y daños a la salud ecosistémica y humana las proliferaciones de especies como los dinoflagelados A. sanguínea, G. catenatum, M. polykrikoides y Prorocentrum mexicanum; así como diatomeas del género Pseudo-nitzschia y Thalassiosira y cianobacterias como Trichodesmium erytrhaeum.
Una de las principales amenazas de la toxicidad en el ecosistema, es su potencial efecto e impacto sobre las pesquerías de especies de moluscos bivalvos como Argopecten ventricosus, Tivela stultorum, Lyropecten sub nudosus, Anadará tuberculosa, Megapitaria aurantianca y Pinna rugosa, ya que estos organismos tienden a acumular toxinas en sus tejidos, convirtiéndose en un riesgo latente para la salud humana (Gárate-Lizárraga et al., 2001)
Es importante mencionar que las granjas acuícolas de peces y sobre todo crustáceos como el camarón son una fuente de nutrientes orgánicos e inorgánicos derivados del proceso de alimentación empleado en su cultivo, mismos que pueden incidir en la proliferación de especies fitoplanctónicas, lo cual puede ser favorable para el organismo en cultivo sobre todo al proliferar diatomeas o microalgas verdes. Esta situación puede tornarse catastrófica cuando las especies producen toxinas como es el caso de algunos dinoflagelados (Cortés-Altamirano y Licea-Durán, 1999) o cuando su proliferación alcanza niveles tan altos que sin producir toxinas pueden ocasionar daño al sistema de cultivo.
Es por ello, que consideramos de gran importancia mantener el monitoreo de estos fenómenos en nuestras costas, y una vez detectados continuar con su muestreo y análisis que nos permitan caracterizar estos eventos con base en su periodicidad de incidencia y especies que los producen para así poder evaluar su potencial daño ecológico o a la salud humana
Referencias.
Band-Schmidt, C., A. Martínez-López e I. Gárate-Lizárraga. 2005. First record of Chattonella marina in Bahía de la Paz, Gulf of California. Harmful Algae News, 28,
6–7.
Blake, S.D., M. McPherson, M. Karnauskas, S. R. Sagarese, A. Rios, A.D. Stoltz, A. Mastitski y M. Jepson. 2022. Use of fishermen’s local ecological knowledge to understand historic red tide severity patterns, Marine Policy, 145 105-253.
Cortés-Altamirano, R. 1984. Mareas rojas producidas por el ciliado Mesodinium rubrum
(Lohman) en el área litoral de Mazatlán, Sinaloa, México. Biótica, 9: 259- 270.
Cortés-Altamirano, R. y S. Licea-Durán. 1999. Florecimientos de microalgas nocivas en estanques de cultivo semi-intensivo de camarón en México. Revista Latinoamericana de Microbiología, 41, 157–166.
Cortés-Ortiz, R.A., G. Ponce-Díaz y M. Ángeles-Villa. 2003. El sector pesquero en Baja California Sur: un enfoque de insumo-producto. Región y Sociedad, 18(35) 107-129.
Gárate-Lizárraga, I., M. L. Hernández-Orozco, C.J. Band-Schmid y G. Serrano-Casillas. 2001. Red tides along the coasts of Baja California Sur, México (1984 to 2001). Oceánides, 16(2), 127–134.
Gárate-Lizárraga, I., M.S. Muñetón-Gómez y V. Maldonado-López. 2006. Florecimiento del dinoflagelado Gonyaulax polygramma frente a la Isla Espíritu Santo, Golfo de California (octubre, 2004). Revista de Investigaciones Marinas, 17, 31–39.
Gárate-Lizárraga, I. y R.E. Muciño-Márquez. 2012. Blooms of Trichodesmium erythraeum and T. thiebautii(Cyanobacteria, Oscillatoriales) in the Bahía de La Paz, Gulf of California. CICIMAR, Oceánides 27, 61–64.
Gárate-Lizárraga I., Y.B. Okolodkov y R. Cortés-Altamirano. 2016a. Microalgas formadoras de florecimientos algales en el Golfo de California. En: García-Mendoza, E., Quijano-Scheggia, S.I. Olivos-Ortiz, A. y Núñez-Vázquez, E.J. (Eds.). Florecimientos Algales Nocivos en México. CICESE, Ensenada, B.C.S., México, pp. 131-145.
Gárate-Lizárraga, I., G. Verdugo-Díaz, Y. Okolodkov. 2016b. Florecimientos algales |nocivos en la costa occidental de Baja California Sur. En: García-Mendoza, E., Quijano-Scheggia, S.I., Olivos-Ortiz, A., y Núñez Vázquez, E.J. (Eds.), Florecimientos Algales Nocivos en México. CICESE, Ensenada, México, pp. 44-59
Hernández-Orozco, M.L. y I. Gárate-Lizárraga. 2006. Síndrome de envenenamiento paralizante por consumo de moluscos. Revista Biomédica. 17(1): 45-60.
López-Cortés, D.J., I. Gárate-Lizárraga, J.J. Bustillos-Guzmán y F.E. Hernández-Sandoval. 2008. Blooms of Myrionecta rubra in Bahía de La Paz, Gulf of California, México in early summer 2005. CICIMAR Oceánides 23, 1–10.
Montoya, N.G., M.O. Carignan y M.B. Mattera. 2020. Toxinas Algales en el Mar Argentino: nuevos hallazgos, nuevos desafíos. Acta Toxicológica Argentina 28, 92–107.
Ochoa, J.L., E.J. Núñez-Vázquez y J. Saad. 2003. Diferentes términos utilizados para describir las “Mareas Rojas”. Revista de Biología Tropical, 51(3-4), 621-627
Reyes-Salinas, A., C.J. Band-Schmidt, F.E. Hernández-Sandoval, I. Leyva-Valencia, E.J. Núñez-Vázquez y J.J. Bustillos-Guzmán. 2023. Florecimientos algales nocivos (“mareas rojas”): ¿qué son, porque son nocivos y para qué servirán? Recursos Naturales y Sociedad, 9 (3): 59-77.
Suárez-Isla, B. y L. Guzmán-Méndez. 1999. Mareas rojas y toxinas marinas: floraciones de algas nocivas / Colección orientaciones en ciencia, tecnología y cultura / Red tide and marine toxins: blooming of noxious algae, Santiago de Chile; Universitaria, 77 p.
Visciano, P, M. Schirone, M. Berti, A. Milandri, R. Tofalo, y G. Suzzi. 2016. Marine Biotoxins: Occurrence, Toxicity, Regulatory Limits and Reference Methods. Frontiers in Microbiology. 7:1051
